Le CO₂, c’est fou non ?
Le CO₂ réagit avec l’eau pour former de l’acide carbonique :
CO₂ + H₂O ⇌ H₂CO₃ ⇌ H⁺ + HCO₃⁻
Et hop ça fait des ions H⁺ qui vont réagir avec le CaCO₃.
En fonction du taux de CO₂ le pH varie donc. La variation existe, mais reste limitée dans des conditions normales.
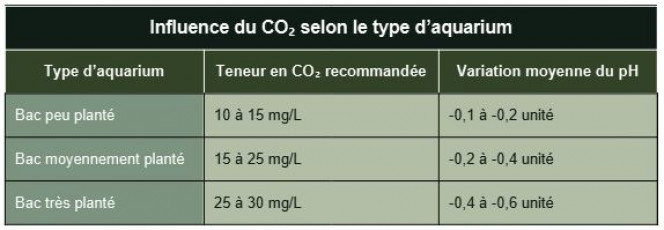
Influence du CO₂ selon le type d’aquarium
Voir le tableau
Ces variations sont observées en eau douce avec KH modéré (2–6 °dKH).
Ces valeurs sont indicatives car la baisse de pH dépend aussi du pouvoir tampon de l’eau (KH), de l’agitation en surface, et du volume du bac. Mais elles donnent une idée de l’impact du CO₂ sur l’acidité et donc sur la solubilité du calcaire. Ces variations sont observées en eau douce avec KH modéré (2–6 °dKH).
Back dans les bacs
Si vous utilisez de l’eau du robinet plus ou moins coupée avec de l’eau osmosée / de pluie votre pH est probablement supérieur à 7 et la dissolution sera négligeable. Si c’est un biotope des grands lacs africains ce n’est évidemment pas un problème.
Si vous avez une eau acide, si vous utilisez du sol technique, le CaCO₃ qu’il soit dans le décor ou dans l’eau est à éviter.
Jamais de pierre calcaire dans un aquarium ! Mythe ou légende ?
Les forces en présence
Le calcaire ou plutôt le carbonate de calcium (CaCO₃) est un composé chimique (un atome de calcium + un de carbone + trois d'oxygène) présent dans de nombreuses roches (calcaires, marnes, marbres, dolomies. Il provient de la compaction de sédiments biologiques (coquilles, coraux, algues calcifiantes) ou de précipitations chimiques en milieu aquatique.
La dureté de l’eau... Afficher la suite
Jamais de pierre calcaire dans un aquarium ! Mythe ou légende ?
Les forces en présence
Le calcaire ou plutôt le carbonate de calcium (CaCO₃) est un composé chimique (un atome de calcium + un de carbone + trois d'oxygène) présent dans de nombreuses roches (calcaires, marnes, marbres, dolomies. Il provient de la compaction de sédiments biologiques (coquilles, coraux, algues calcifiantes) ou de précipitations chimiques en milieu aquatique.
La dureté de l’eau se mesure par deux paramètres :
- GH (Gesamthärte, dureté totale) : concentration en ions calcium (Ca²⁺) et magnésium (Mg²⁺).
- KH (Karbonathärte, dureté carbonatée) : concentration en carbonates (CO₃²⁻) et bicarbonates (HCO₃⁻), qui servent de tampon au pH.
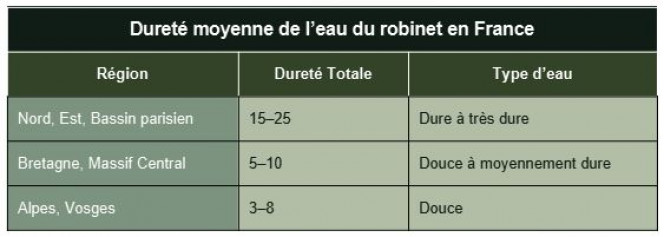
Une eau est dite douce lorsqu’elle est faiblement minéralisée, et dure lorsqu’elle contient beaucoup de sels dissous.
Le pH (potentiel hydrogène) mesure l’acidité ou la basicité d’une solution aqueuse. Il correspond à la concentration en ions hydrogène (H⁺) dans l’eau.
Un pH inférieur à 7 indique une eau acide, 7 correspond à la neutralité, supérieur à 7 indique une eau basique.
L’échelle du pH est inversée et logarithmique. Inversée, car plus la valeur du pH est basse, plus la concentration en H⁺ est forte. Logarithmique, car chaque unité de pH représente un facteur 10. Ainsi, une eau à pH 6 contient cent fois plus de H⁺ qu’une eau à pH 8.
Never say Never Again
Les roches contenant du carbonate de calcium peuvent avoir une influence importante sur nos précieux “paramètres de l'eau”, en l'occurrence la dureté.
La dissolution du CaCO₃ dans l'eau augmente la dureté, elle libère des ions calcium (Ca²⁺ → GH) et carbonate (CO₃²⁻ → KH).
Le CaCO₃ peut se dissoudre assez facilement dans l'eau, d'où les avertissements : You shall not pass!
Le CaCO₃ peut se dissoudre assez facilement dans l'eau... ou pas. You shall pass!
J’ai décidé de dissoudre…
L’équation suivante explique tout ou presque :
CaCO₃ (s) + 2H⁺ (aq) → Ca²⁺ (aq) + CO₂ (g) + H₂O (l)
Cette équation montre que :
- Le carbonate de calcium (CaCO₃) solide réagit avec les ions H⁺ (acidité)
- Il libère des ions calcium (Ca²⁺) qui augmentent le GH
- Il produit du dioxyde de carbone (CO₂) qui peut s’échapper
- Et de l’eau, et ça on s'en fiche .
Je suis une légende :
(s) → solide
(l) → liquide
(g) → gaz
(aq) → aqueous, en anglais, soit en solution aqueuse
En résumé : Plus le milieu est acide, plus il y a d’ions H⁺, plus le calcaire est dissout.
La suite en commentaire









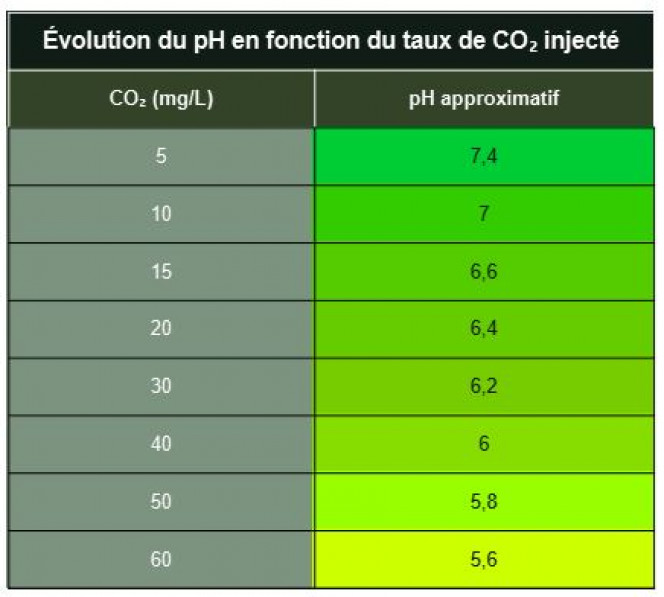


Oui. Entre 7 et 8 il ne se passe pas grand chose au dessus de 8,il ne se passe plus rien.